Departamento de Neuroquímica, Maj Institute of Pharmacology, Polish Academy of Sciences, 31-343 Cracóvia, Polônia
*
Autor a quem a correspondência deve ser endereçada.
†
Estes autores contribuíram igualmente para este trabalho.
Recebido: 31 de outubro de 2020 / Revisado: 19 de novembro de 2020 / Aceito: 20 de novembro de 2020 / Publicado: 23 de novembro de 2020
(Este artigo pertence à Edição Especial Canabidiol: Novas Vistas de Seus Mecanismos Moleculares, Efeitos Biológicos e Aplicação Terapêutica )
Abstrato
A cannabis tem uma longa história de uso médico. Embora existam muitos canabinóides presentes na cannabis, Δ9tetrahidrocanabinol (Δ9-THC) e canabidiol (CBD) são os dois componentes encontrados nas concentrações mais elevadas. O próprio CBD não produz efeitos canabimiméticos comportamentais típicos e não foi considerado responsável pelos efeitos psicotrópicos da cannabis. Numerosos achados anedóticos atestam os efeitos terapêuticos do CBD, que em alguns casos foram confirmados por achados de pesquisas. No entanto, os dados sobre o mecanismo de ação e potencial terapêutico do CBD são abundantes e onifários. Portanto, revisamos a pesquisa básica a respeito do mecanismo molecular de ação do CBD, com foco particular em seu potencial analgésico. Além disso, este artigo descreve os efeitos analgésicos e antiinflamatórios detalhados do CBD em vários modelos, incluindo dor neuropática, dor inflamatória, osteoartrite e outras. A dose e a via do efeito dependente da administração do CBD, na redução da dor, hiperalgesia ou alodinia, bem como na produção de citocinas pró e antiinflamatórias, foram descritas dependendo do modelo da doença. As aplicações clínicas de medicamentos contendo CBD também são mencionadas. Os dados aqui apresentados desvendam o que se sabe sobre os efeitos farmacodinâmicos e analgésicos do CBD para fornecer ao leitor o conhecimento atual sobre a ação do CBD e as perspectivas futuras de pesquisa. foram descritos dependendo do modelo da doença. As aplicações clínicas de medicamentos contendo CBD também são mencionadas. Os dados aqui apresentados desvendam o que se sabe sobre os efeitos farmacodinâmicos e analgésicos do CBD para fornecer ao leitor o conhecimento atual sobre a ação do CBD e as perspectivas futuras de pesquisa. foram descritos dependendo do modelo da doença. As aplicações clínicas de medicamentos contendo CBD também são mencionadas. Os dados aqui apresentados desvendam o que se sabe sobre os efeitos farmacodinâmicos e analgésicos do CBD para fornecer ao leitor o conhecimento atual sobre a ação do CBD e as perspectivas futuras de pesquisa.
Palavras-chave: CBD ; farmacologia de rede ; dor ; neuropático ; osteoartrite
1. Introdução
Cannabis sativa L. tem uma longa história de uso médico com alguns dos primeiros registros encontrados em papiros médicos egípcios datando de cerca de 1550 aC [ 1 ]. Embora existam muitos canabinoides presentes em Cannabis sp., Δ 9 tetrahidrocanabinol (Δ9-THC) e canabidiol (CBD) são os dois componentes encontrados nas concentrações mais altas (para revisão das interações complexas entre fitocanabinóides [ 2]). O Δ9-THC é o ingrediente psicoativo primário da cannabis com uma atividade agonista parcial estabelecida em ambos os receptores canabinóides canônicos, CB1 e CB2. Portanto, o Δ9-THC foi um assunto natural de milhares de estudos sobre farmacologia, toxicidade e potencial terapêutico dos canabinóides nos anos que se seguiram. Esta pesquisa levou à descoberta do sistema endocanabinóide, que consiste em receptores canabinóides acoplados à proteína G (GPCR) e seus ligantes endógenos, endocanabinóides, anandamida (AEA) e 2-araquidonoilglicerol (2AG). Endocanabinóides são compostos lipídicos que são metabolizados em várias vias enzimáticas envolvendo enzimas específicas, como amida hidrolase de ácido graxo (FAAH), monoacilglicerol lipase ou vias alternativas envolvendo enzimas não específicas, muitas vezes interligadas com mediadores inflamatórios,3 ]). Essa interação entre as vias metabólicas ocorre devido à semelhança estrutural entre as prostaglandinas e os endocanabinóides. No entanto, os efeitos primários dos endocanabinóides dependem da ativação do GPCR e do tipo de subunidade α acoplada ao receptor. CB1 e CB2 são pares primários com a subunidade Gαi / o, que inibe a atividade da adenilato ciclase e, portanto, reduz a concentração de Ca 2+ intracelular . Apesar da especificidade do mecanismo de ação dos endocanabinoides, interações metabólicas complexas entre o sistema endocanabinoide e os mediadores inflamatórios também precisam ser levadas em consideração ao estudar os efeitos de vários medicamentos à base de canabinoides.
Embora isolado mais cedo [ 4 ] do que o Δ9-THC, o CBD permaneceu uma substância mais evasiva e pouco estudada, porque o próprio CBD não produz efeitos canabimiméticos comportamentais típicos e não foi considerado responsável pelos efeitos psicotrópicos da cannabis [ 5 ]. O complicado status legal do CBD, em todo o mundo, restringia ainda mais a pesquisa e o conhecimento profissional sobre o potencial terapêutico desse composto. Apesar das limitações, vários achados anedóticos atestam os efeitos terapêuticos do CBD, incluindo efeitos anticonvulsivantes, antipsicóticos, ansiolíticos, neuroprotetores e de promoção do sono, que são posteriormente apoiados por pesquisas [ 6 ]. A evidência clínica inicial sugere que o CBD possui um perfil de segurança desejável [7 ], enquanto vários achados pré-clínicos apresentam efeitos antiinflamatórios do CBD [ 8 , 9 , 10 , 11 , 12 ]. No entanto, a farmacodinâmica do CBD tem sido difícil de elucidar. Relatórios iniciais demonstraram que o CBD compete pouco com ligantes canabinoides no local ortostérico dos receptores canabinoides [ 13 ], levando à conclusão de que qualquer ação do CBD ocorre independentemente dos receptores canabinoides. Outros estudos revelaram esta conclusão como parcialmente verdadeira. Na verdade, o CBD interage diretamente com vários receptores, enzimas e canais iônicos; no entanto, também foi demonstrado que interage direta e indiretamente com o sistema endocanabinoide [ 14 ].
Tomados em conjunto, esses achados iniciais implicam que o CBD representa uma opção promissora de tratamento à base de fitocanabinoides. No entanto, os dados relativos ao seu mecanismo de ação e potencial terapêutico são abundantes e onifários. Portanto, revisamos a pesquisa básica a respeito dos mecanismos moleculares das ações do CBD, com foco particular em seu potencial analgésico. Os dados apresentados aqui desvendam o que se sabe sobre os efeitos farmacodinâmicos e analgésicos do CBD para fornecer aos leitores o conhecimento atual sobre a ação do CBD e as perspectivas futuras de pesquisa. Um resumo dos dados discutidos neste documento será compartilhado como Materiais Suplementares .
2. Mecanismo de ação
2.1. GPCRs
Como mencionado acima, a ligação do CBD ao local ortostérico dos receptores canabinóides é fraca, com a maioria dos estudos relatando um Ki na faixa micromolar [ 14 , 15 , 16 , 17 , 18 ] com uma exceção apresentando Ki = 34 nM e agonismo parcial do CBD dos receptores CB2 humanos em células HEK293A [ 14 ]. Surpreendentemente, doses muito menores de CBD, na faixa nanomolar, foram capazes de antagonizar os efeitos desencadeados pelos agonistas ortostéricos de CB1 e CB2, CP55940 e R - (+) - WIN55212 [ 17 ]. Desenvolvimentos recentes em estudos farmacológicos explicaram esse fenômeno por meio da modulação alostérica negativa dos receptores canabinoides [ 14 ,18 ]. Além disso, deve-se notar que a co-administração de CBD in vitro distorce o viés de sinalização de vários ligantes canabinóides [ 19 , 20 ].
O estado atual de conhecimento expôs o mecanismo de ação do CBD como distinto do sistema endocanabinoide. Os estudos freqüentemente apresentam os efeitos do CBD como mediados pelo receptor serotoninérgico 5HT1a (5HT1a), que, semelhante aos receptores canabinóides, é acoplado à proteína Gi. Embora a ligação de CBD ao local ortostérico de 5HT1a seja relativamente fraca (Ki = 16 mM [ 21 ]), 100 nM de CBD produziu um deslocamento para cima na curva de resposta de concentração log do agonista 5HT1a 8-OH-DPAT que resultou em um resultado estatisticamente significativo aumento no Emax [ 22 ], sugerindo modulação alostérica positiva de 5HT1a.
O CBD também interage com vários GPCRs órfãos (GPR). O CBD é antagonista para GPR55 (EC50 = 445 nM) [ 23 ] juntamente com a proteína G 13 alfa, regulando a remodelação do citoesqueleto de actina nas células durante o movimento e a migração [ 24 ]. Outros métodos também mostraram que GPR55 usa G q , G 12 ou G 13 para a transdução de sinal, resultando na ativação a jusante de RhoA e PLC [ 24 , 25 , 26] Este modo de sinalização está associado a mudanças temporais no cálcio citoplasmático, diacilglicerol ligado à membrana e topologia da membrana plasmática. O GPR55 é amplamente expresso no cérebro, mas sua função fisiológica ainda não está clara. O CBD também é um agonista inverso para GPR3, GPR6 e GPR12, com valores de EC50 de 1220 nM, 180 nM e 10.000 nM, respectivamente [ 27 , 28 ]. GPR3, GPR6 e GPR12 são os principais responsáveis pelo crescimento de neurites, sobrevivência e proliferação celular, mas também foram implicados no desenvolvimento da dor neuropática [ 29 ].
Estudos também revelaram que o CBD se liga a outros receptores acoplados a Gi, a saber, receptores opioides, receptor opioide μ (MOR) e receptor opioide δ (DOR) com Ki = 7000 nM e Ki = 10.000 nM, respectivamente, ou Ki = 11 nM para receptores D2 com alta afinidade funcional para dopamina. Um estudo computacional recente revelou que o receptor de dopamina D3 é um novo alvo previsto para a ação do CBD [ 30 ]. Os destinos GPCR são resumidos esquematicamente na Figura 1 .
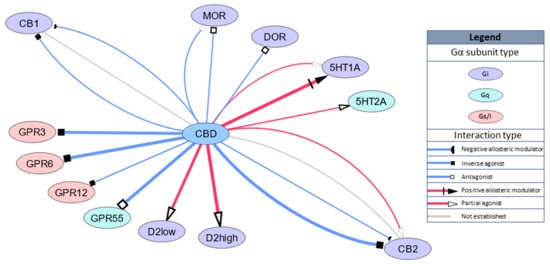
Figura 1. Representação esquemática dos alvos GPCR do canabidiol (CBD). A largura das
bordas (linhas) representa afinidade relativa ou EC / IC50 para o alvo (intervalo 11–1000 nM).
2.2. Receptores Ionotrópicos
A alta atividade dos receptores ionotrópicos é um contribuinte significativo para os efeitos fisiológicos do CBD. Os canais de potencial receptor transitório (TRP) são um grupo de canais iônicos catiônicos localizados principalmente na membrana plasmática de vários tipos de células animais. O CBD ativa TRPA1, TRPV1 e TRPV4 em baixas concentrações nanomolares [ 31 , 32 , 33 ] e TRPV2 em altas concentrações micromolares [ 31 , 34 , 35 ]. Além disso, o CBD é um antagonista para TRPM8 com um IC50 de aproximadamente 80 nM [ 31 , 32 ] e modulador alostérico negativo para o receptor de serotonina 5HT3a (IC50 = 600 nM, [ 36]) e receptor nicotínico de acetilcolina α7 (IC50 = 11.300 nM, [ 37 ]), que também são seletivos para íons carregados positivamente. Por outro lado, o CBD também é um modulador alostérico positivo em faixas de concentração micromolar para canais iônicos dependentes de ligante aniônico, como GABA A [ 38 ] e receptores de glicina (GlyRs) [ 39 ]. O CBD também inibe as correntes catiônicas através dos canais de cálcio controlados por voltagem Cav3.1 e Cav3.2 com IC50 de aproximadamente 800 nM [ 40 ] e canais de sódio dependentes de voltagem e Cav3.3 com IC50 de aproximadamente 3000 nM [ 40 , 41 ]. O CBD também demonstrou interagir diretamente com o canal 1 de ânion dependente de voltagem (VDAC1), diminuindo sua condutância [42 ]. Os alvos ionotrópicos são resumidos esquematicamente na Figura 2 .
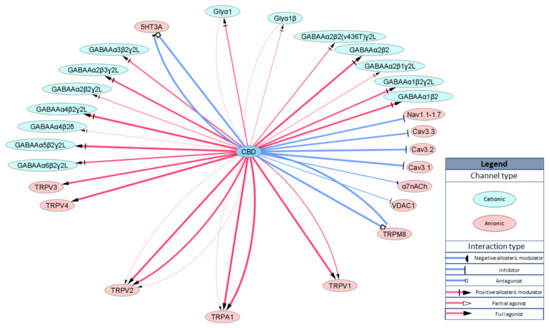
Figura 2. Representação esquemática de alvos ionotrópicos CBD. A largura das bordas (linhas)
representa a EC / IC50 relativa variando entre 60 e 20.000 nM.
2.3. Transportadores
O CBD também é capaz de se ligar a transportadores intracelulares de endocanabinoides, incluindo proteínas de ligação de ácidos graxos 1, 3, 5 e 7 (Ki = 167, 1690, 1880 e 1520 nM, respectivamente), aumentando indiretamente as ações endocanabinoides por meio da inibição da captação de anandamida [ 43 , 44 ]. De fato, a administração de CBD aumenta os níveis de AEA em cérebros de ratos de maneira dependente de N-acilfosfatidiletanolamina fosfolipase D [ 45 ] e em soro humano [ 46 ]. Além disso, baixas concentrações nanomolares de CBD (IC50 = 124 nM) inibem o transportador de nucleosídeo equilibrado (ENT) e a captação de adenosina, o que está subjacente aos efeitos antiinflamatórios e, possivelmente, de promoção do sono do CBD [ 47 , 48] A atividade de CBD para outras proteínas transportadoras, como proteínas de resistência a múltiplas drogas (proteína 1 associada a resistência a múltiplas drogas (ABCC1), membro da família G da cassete de ligação de ATP 2 (ABCG2) ou glicoproteína P) ou Mg2 + -ATPase, também foi estudada ; no entanto, valores de IC50 acima de 3000 nM sugerem que estes são fisiologicamente irrelevantes. Os alvos do transportador são resumidos esquematicamente na Figura 3 .

Figura 3. Representação esquemática dos alvos do transportador CBD. A largura das
bordas (linhas) representa a EC / IC50 relativa variando entre 100 e 10.000 nM.
2.4. Enzimas
Outro grupo importante de alvos CBD são as enzimas. A superfamília do citocromo P450 (CYPs) de enzimas é de particular interesse, pois a interação entre o CBD e os CYPs pode influenciar a depuração de vários medicamentos, incluindo os antiinflamatórios não esteroides muito comumente usados. Foi demonstrado que o CBD se liga e inibe a atividade de vários CYPs, incluindo CYP1B1, CYP2C19, CYP2C9, CYP3A4 e CYPC3A7, em concentrações fisiologicamente relevantes, com valores de IC50 proeminentes para CYP1A1 e CYP3A5 (IC50 = 77 e 195 nM, respectivamente). Devido às propriedades estruturais do CBD, ele também pode interagir com várias enzimas envolvidas no metabolismo de lipídios, a maioria das quais está envolvida no metabolismo de AEA. O CBD inibe a atividade FAAH de rato com IC50 = 1520 nM [ 31 ], mas o IC50 para a isoforma humana de FAAH é superior a 25.000 nM [33 ], que exclui FAAH como um possível alvo para a atividade do CBD em humanos. Por outro lado, o CBD inibe lipooxigenases de enzimas alternativas e inespecíficas (LOXs) envolvidas na degradação de AEA e produção de fatores inflamatórios do ácido araquidônico: LOX15 com IC50 = 2560 nM e LOX5 com IC50 = 73.730 nM [ 49 ]. Outros estudos apresentaram o CBD como um estimulador da COX1 ovina e da COX2 recombinante humana com um IC50 de aproximadamente 10.000 nM [ 50 ] ou como um inibidor da fosfolipase A2 (PLA2) do veneno Naja naja com um IC50 = 6400 nM [ 51 ]. O CBD também demonstrou inibir os complexos mitocondriais I, II e IV, mas com potência muito baixa (IC50 = 8200-19,100 nM) [ 52] Além disso, o CBD inibe a enzima envolvida na conversão de serotonina em melatonina, aralquilamina N-acetiltransferase (AANAT) com IC50 = 1000 nM [ 53 ], e uma enzima envolvida no catabolismo de triptofano, indoleamina-pirrol 2,3-dioxigenase (IDO) com IC50 = 8900 nM [ 54 ]. Poucos estudos examinaram a interação do CBD com enzimas envolvidas no metabolismo de esteróides, como acil-CoA colesterina aciltransferase (ACAT) ou testosterona hidroxilase; no entanto, os valores de IC50 não foram especificados ou a concentração que foi utilizada estendeu-se além dos valores fisiologicamente relevantes [ 55 , 56 ]. Os alvos enzimáticos são resumidos esquematicamente na Figura 4 .
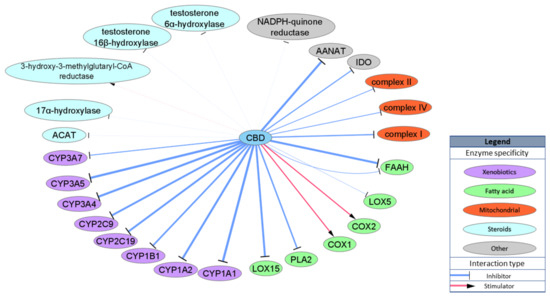
Figura 4. Representação esquemática dos alvos da enzima CBD. A largura das bordas (linhas)
representa a EC / IC50 relativa variando entre 77 e 30.000 nM.
2,5. Fatores Nucleares
Um dos alvos mais importantes do CBD é o receptor nuclear do receptor ativado por proliferador de peroxissoma (PPARγ), especialmente no contexto de inflamação. Primeiro, foi demonstrado que o CBD tem baixa potência como um agonista total (EC50 = 20.100 nM) [ 57 ]; embora um estudo posterior de Hedge et al., estabeleceu um EC50 de aproximadamente 100 nM [ 58 ]. Além disso, os estudos de Juknat et al. revelaram que o fator nuclear derivado de eritróide 2-like 2 (Nrf2) foi responsável pela modulação mediada por CBD dos padrões de expressão de genes inflamatórios em células da microglia ativadas [ 59 ].
2.6. Resumo de alvos farmacológicos fisiologicamente relevantes
Identificamos um total de 76 alvos moleculares diferentes de CBD. Entre eles, enzimas e canais iônicos / receptores ionotrópicos constituem a maioria dos alvos. GPCRs e proteínas transportadoras são alvos menos abundantes do CBD, e existem apenas dois alvos diferentes que são receptores nucleares. Entre as enzimas, o CBD interage potentemente com várias enzimas CYP450 envolvidas no metabolismo de drogas, o que levanta preocupações sobre possíveis interações medicamentosas. Numerosos alvos entre os canais iônicos e os receptores ionotrópicos podem explicar a eficácia do CBD como fármaco para o controle de convulsões, mas também podem contribuir para a ação antinociceptiva do CBD. Por outro lado, alvos entre GPCRs e transportadores representam uma ligação entre as ações do CBD e o sistema endocanabinoide por causa da alta atividade do CBD para as proteínas FABP e modulação alostérica dos receptores canabinoides.Figura 5 . Também analisamos o número de possíveis interações com receptores transmembrana em relação a possíveis resultados no potencial de membrana celular e atividade celular. Receptores acoplados à proteína Gi ou canais permeáveis a ânions foram considerados inibidores, enquanto os canais permeáveis a cátions juntamente com GPCRs acoplados a Gq e possivelmente Gs foram considerados estimuladores. Esta análise revelou que quase 75% das interações diretas CBD-receptor devem inibir a atividade celular, enquanto apenas 26% das interações foram capazes de estimular a atividade celular. Mais dos efeitos farmacológicos do CBD, incluindo a modulação de fatores de citocinas, função celular e espécies reativas de oxigênio podem ser encontrados na tabela do apêndice no artigo de McPartland et al., 2014 [ 60 ].
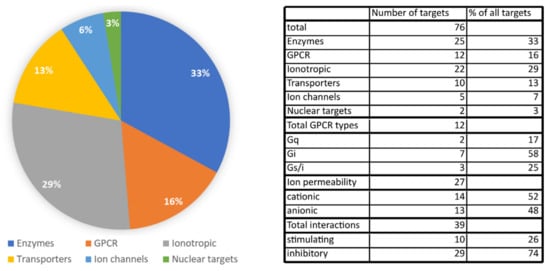
Figura 5. Gráfico de pizza mostrando a porcentagem de alvos proteicos específicos de CBD de um
conjunto de todos os alvos proteicos. Tabela que apresenta o número de alvos CBD identificados
e a porcentagem de proteínas Gα específicas acopladas aos receptores GPCR e a permeabilidade iônica
de ambos os canais iônicos e receptores ionotrópicos. O número total de efeitos finais no potencial
de membrana celular foi calculado com base no tipo de proteínas Gα acopladas a receptores
GPCR direcionados por CBD e permeabilidade iônica desses alvos juntamente com a ação
farmacológica de CBD (por exemplo, a inibição do canal iônico aniônico foi contada como efeito estimulador).
3. O potencial analgésico do CBD
Estudos pré-clínicos e clínicos sugerem um potencial efeito antinociceptivo do CBD e do CBD combinados com outros compostos em várias doenças relacionadas à dor. Os efeitos analgésicos podem variar dependendo da dose e da via de administração do medicamento. A seção a seguir resume as descobertas mais recentes em várias doenças relacionadas à dor e a eficácia do CBD no controle da dor.
Vários estudos relataram que, em roedores saudáveis submetidos a uma experiência dolorosa (por exemplo, movimento da cauda ou teste de pressão da pata), a administração de CBD pode diminuir a experiência nociceptiva. Além disso, dependendo do projeto experimental, o CBD pode potencializar ou antagonizar o efeito do Δ9-THC. Microinjeções intra-ventrolaterais de cinza periaquedutal (PAG) de CBD ou canabicromeno (CBC) resultaram em uma redução dependente da dose na atividade contínua de neurônios ON e OFF em ratos anestesiados e causaram analgesia, medida pelo teste de movimento da cauda (os efeitos foram antagonizados por antagonistas seletivos de CB1, adenosina A1 e TRPA1, mas não de receptores TRPV1) [ 61] Por sua vez, em relação aos efeitos do CBD no Δ9-THC, Britch et al. chegou a conclusões inconsistentes. Em seu estudo, o CBD sozinho não teve efeito antinociceptivo, no entanto, aumentou a atividade locomotora dos animais. Quando administrado 15 min antes do Δ9-THC, o CBD aumentou a pressão da pata induzida pelo Δ9-THC, mas não a retirada da cauda, antinocicepção e aumentou a hipolocomoção de ratos (em dose baixa de Δ9-THC). No entanto, quando administrado 13 h ou 15 min antes do Δ9-THC (na menor dose testada de 1,8 mg / kg), o CBD (na dose mais alta testada de 30 mg / kg) não teve efeito sobre o efeito do Δ9-THC e inibiu o Δ9- Metabolismo do THC (este efeito foi mais proeminente em mulheres do que em homens) [ 62] Greene et al. demonstraram que a administração diária crônica de CBD aumentou o desenvolvimento de tolerância à antinocicepção induzida por Δ9-THC, provavelmente devido à inibição induzida por CBD do metabolismo de Δ9-THC ou devido ao antagonismo dos efeitos de Δ9-THC após tratamento repetido [ 63 ]. A neuromodulação mediada por canabinoides também pode estar envolvida na antinocicepção mediada por estimulação elétrica nervosa transcutânea (TENS), uma terapia não farmacológica para o tratamento da dor. Em ratos submetidos à TENS de 10 ou 150 Hz, o CBD e a naloxona aboliram os efeitos antinociceptivos da TENS de 10 e 150 Hz [ 64 ].
3.1. Modelos animais de dor neuropática
A dor neuropática surge de lesão nervosa direta ou de uma doença e afeta o sistema nervoso somatossensorial. Hiperalgesia, uma sensação de dor excessiva, pode ser acompanhada por alodínia, uma sensação dolorosa de estímulo neutro. A dor neuropática é persistente e difícil de aliviar; portanto, é necessária a identificação de novas estratégias terapêuticas mais eficazes.
O CBD exerce efeito analgésico em vários modelos de dor neuropática. Em um modelo de camundongo com lesão do nervo ciático, a gelatina contendo CBD administrada por via oral ad libitum reduziu significativamente a alodinia até 3 semanas após a cirurgia. Resultados semelhantes foram obtidos nos grupos Δ9-THC e morfina gelatina; entretanto, a tolerância à morfina se desenvolveu após uma semana de tratamento, o que não foi observado após o tratamento com CBD ou Δ9-THC. Além disso, o mesmo estudo não revelou nenhum efeito significativo do CBD na redução da hiperalgesia, embora uma tendência analgésica tenha sido observada [ 65] Em ratos, após a ligadura do nervo espinhal L5, o CBD e seus derivados modificados (diidroxil-CBD e didesoxi-CBD) suprimiram a dor neuropática crônica. O efeito analgésico foi correlacionado com a potenciação canabinoide dos α3 GlyRs, mas não com sua afinidade de ligação para os receptores CB1 e CB2. Além disso, as correntes de glicina nos neurônios do corno dorsal em fatias da medula espinhal de ratos neuropáticos foram aumentadas por canabinóides [ 66 ]. Em um modelo de dor neuropática crônica de camundongo envolvendo lesão do nervo trigêmeo infraorbital de constrição inflamatória do forame rotundo, o CBD administrado por via oral em um veículo de manteiga de amendoim aliviou a alodinia mecânica em 1 he permaneceu significativo por 6 h [ 67] A eficácia do CBD também foi demonstrada em um modelo animal de dor neuropática com lesão de constrição crônica (ICC). A administração oral e subcutânea de CBD resultou na redução da alodinia mecânica e térmica induzida por cirurgia [ 12 , 68 ]. Costa et al. também observaram redução no conteúdo de vários mediadores da dor ( concentração plasmática de prostaglandina E 2 e malondialdeído no tecido da pata, óxido nítrico e níveis de enzimas relacionadas à glutationa) em resposta à administração oral de 20 mg / kg de CBD. O efeito anti-hiperalgésico foi prevenido pela capsazepina (o antagonista do receptor vaniloide), mas não pelo rimonabanto ou SR144528 (antagonistas dos receptores CB1 e CB2, respectivamente) [ 12] O Δ9-THC tem efeitos mais fortes na redução da dor do que o CBD; no entanto, os efeitos colaterais excluem seu uso clínico. No entanto, a coadministração de Δ9-THC e CBD proporcionou um aumento de 200 vezes na eficácia da dose baixa, sem efeitos colaterais observados (apenas altas doses coadministradas causaram efeitos colaterais, semelhantes aos observados com Δ9-THC sozinho) [ 68 ] . Após a lesão da medula espinhal, o CBD pode atuar como um agente antiinflamatório. Li et al. demonstraram que as injeções de CBD intraperitoneal (ip) atenuaram a invasão de citocinas pró-inflamatórias e quimiocinas e evitaram o desenvolvimento de sensibilidade térmica [ 69] Por sua vez, em um modelo de rato de dor neuropática do manguito do nervo ciático periférico, o CBD, bem como a coadministração de Δ9-THC e CBD + Δ9-THC, reduziu a hipersensibilidade e promoveu alterações benéficas nas fibras mecanorreceptivas de Aβ mielinizadas [ 70] O CBD também modula a transmissão serotoninérgica no núcleo dorsal da rafe. A administração intravenosa aguda aumenta a taxa de disparo dos neurônios 5-HT no núcleo dorsal da rafe de ratos. Este efeito foi bloqueado pelos antagonistas dos receptores 5HT1a e TRPV1 (capsazepina e WAY100635, respectivamente). A administração subcutânea repetida de CBD por 7 dias aumenta o disparo de 5-HT por meio da dessensibilização dos receptores 5HT1a em ratos saudáveis. Em um modelo de rato de dor neuropática com lesão de nervo poupado, injeções repetidas de CBD diminuíram a alodinia mecânica, comportamento semelhante à ansiedade e atividade normalizada de 5-HT. Este efeito foi bloqueado pela capsazepina e parcialmente pelo WAY100635 [ 71 ].
Além da neuropatia induzida cirurgicamente, a dor crônica pode ser desencadeada pela administração de substâncias químicas. Por exemplo, paclitaxel quimioterápico (PAC) pode ser responsável pelo desenvolvimento de neuropatia periférica em humanos. Em vários estudos de dor neuropática induzida por PAC, o CBD exerceu um efeito positivo contra a alodinia mecânica e térmica em camundongos e evitou a sensibilidade mecânica. O efeito observado foi revertido pelo antagonista do receptor 5HT1a WAY100635, mas não pelos antagonistas do receptor CB1 ou CB2 [ 72 , 73 , 74 ]. Além disso, a co-administração de CBD e Δ9-THC aumentou o efeito de doses baixas e ineficazes de cada droga isoladamente [ 74] Na neuropatia induzida pela cisplatina, o CBD reduziu a dor neuropática em camundongos, mas não evitou o desenvolvimento da dor, quando administrado 30 minutos antes da cisplatina [ 75 ]. Além disso, Pan et al. demonstraram que o CBD previne o estresse oxidativo / nitrosativo induzido pela cisplatina, inflamação e morte celular no rim e melhora a função renal [ 11 ].
O diabetes tipo 1 costuma estar associado ao desenvolvimento de dor neuropática. Em um modelo de diabetes tipo 1 em roedores, o CBD atrasou o desenvolvimento da doença e exerceu um efeito benéfico na microcirculação pancreática em animais testados (redução na ativação de leucócitos e aumento da densidade capilar funcional) e disfunção miocárdica atenuada, fibrose cardíaca, estresse oxidativo / nitrosativo, inflamação e células morte, enquanto aumenta a capacidade das artérias de relaxar por meio da produção aumentada de produtos derivados da cicloxigenase-1/2 vasodilatadores [ 50 , 76 , 77 ]. A administração intranasal e ip de CBD também atenuou a dor neuropática e inibiu a elevação da densidade microglial e proteína quinases ativadas por mitogênio p38 fosforiladas [ 78] Além disso, em ratos diabéticos induzidos por estreptozotocina, a administração aguda de CBD ip produziu um efeito antialodínico no teste de Von Frey. Este efeito foi mediado pela ativação do sistema serotoninérgico através dos receptores 5HT1a, uma vez que WAY100135, um antagonista seletivo do receptor 5HT1a, mas não CB1, CB2 ou antagonistas da glicina, preveniu o efeito observado. Quando administrado cronicamente, o CBD reduziu a alodinia mecânica e evitou a diminuição dos níveis de serotonina na medula espinhal [ 79 ].
3.2. Dor Inflamatória
A dor inflamatória é causada por estímulos nocivos que ocorrem durante a resposta inflamatória ou imunológica. Em condições normais, a inflamação é um mecanismo protetor crucial, que desempenha um papel importante no processo de cicatrização de feridas. Geralmente é acompanhada de vermelhidão, calor, inchaço, dor / hipersensibilidade e perda de função. No entanto, em condições patológicas, a inflamação pode causar dor de longa duração por meio da ativação de neurônios sensoriais [ 80 ].
Em vários modelos de dor crônica induzida por inflamação, os canabinoides, incluindo o CBD, podem exercer efeitos analgésicos e antiinflamatórios. Um estudo com dor inflamatória induzida por adjuvante completo de Freund (CFA) em roedores revelou um papel importante para o CBD e seus derivados modificados na atenuação da dor crônica [ 66 ]. Em dois modelos murinos adicionais de inflamação induzida, usando óleo de Croton a 2,5% em acetona aplicado topicamente na orelha ou por injeção ip de lipopolissacarídeo (LPS), Verrico et al. demonstraram que o CBD diminuiu os níveis séricos de fatores pró-inflamatórios interleucina 6 (IL-6) e fator de necrose tumoral α (TNFα) e aumentou os níveis da citocina antiinflamatória interleucina 10 (IL-10). Resultados semelhantes Verrico et al. foram obtidos em um modelo in vitro de inflamação no mesmo estudo [81 ]. Por outro lado, Britch et al. demonstraram que a administração ip duas vezes ao dia de Δ9-THC por 3 dias causou redução no comportamento relacionado à dor em um modelo de dor inflamatória induzida por CFA, mas teve pouco ou nenhum efeito nas mudanças nos níveis de citocinas séricas ou edema de pata. Por sua vez, a administração ip de CBD teve efeitos mínimos na dor inflamatória, mas reduziu significativamente os níveis de interleucina 1β (IL-1β), IL-10, interferon γ (IFN-γ) e aumentou os níveis de IL-6 [ 82] Este resultado sugere um papel mais benéfico para o Δ9-THC em comparação com o CBD na atenuação da dor devido aos resultados ambíguos nos níveis de fatores relacionados à inflamação no soro. Conclusões semelhantes podem ser tiradas do trabalho de Karmaus et al., Onde CBD administrado por via oral em óleo de milho aumentou a inflamação pulmonar induzida por LPS, aumentou o infiltrado de células inflamatórias no fluido de lavagem broncoalveolar e aumentou os níveis de mRNA de citocinas pró-inflamatórias (TNFα, IL-6 , interleucina-23 (IL-23), fator estimulador de colônia de granulócitos (GCSF)) [ 83] Em outro estudo, a dor inflamatória foi induzida pela injeção de carragenina, e o efeito do ácido canabidiólico (CBDA), CBD e Δ9-THC foram investigados. A administração ip de CBDA antes da carragenina produziu efeitos anti-hiperalgesia e antiinflamatórios dependentes da dose. Efeitos semelhantes foram obtidos com a administração oral de CBDA e Δ9-THC. Um antagonista do receptor CB1, rimonabant, bloqueou o efeito analgésico de Δ9-THC, enquanto os efeitos do CBDA foram bloqueados por AMG9810 (um antagonista de TRPV1). Infelizmente, neste estudo, o CBD não reduziu a hiperalgesia induzida por carragenina. Este resultado pode sugerir um papel mais potente para CBDA em comparação com CBD na indução de efeitos analgésicos [ 84] Moreno-Martet et al. investigou o papel de Sativex-like (Sativex / Nabiximols é uma droga canabinoide contendo 1: 1 CBD e Δ9-THC) combinado com uma substância de droga botânica Δ9-tetrahidrocanabinol (Δ9-THC-BDS) e droga canabidiol-botânica (CBD- BDS) em um modelo experimental de encefalite autoimune (EAE) de esclerose múltipla em camundongos. Os resultados demonstraram que a combinação do tipo Sativex e Δ9-THC-BDS sozinho melhorou os déficits neurológicos em animais EAE e reduziu o número e a extensão dos agregados celulares na medula espinhal, derivados da infiltração celular no sistema nervoso central. O rimonabant reverteu os benefícios neurológicos observados e reduziu os agregados celulares no grupo tratado com Δ9-THC-BDC. Não obstante, o CBD-BDS sozinho não proporcionou esses efeitos, apenas retardando o início da doença [ 85] Além disso, o CBD melhorou a gravidade da encefalomielite autoimune experimental em camundongos, diminuindo o dano axonal, a inflamação e o recrutamento de células T na medula espinhal de camundongos [ 10 ].
3.3. Dor Relacionada à Artrite
A osteoartrite (OA) é uma doença articular degenerativa que afeta principalmente pessoas com mais de 60 anos. Devido ao aumento do envelhecimento da população e ao aumento das taxas de obesidade, a OA se tornou um problema sério e global. Não há cura para essa doença, e a terapia atual inclui a manutenção da funcionalidade das articulações por meio da reabilitação e perda de peso, com alívio da dor com uso de antiinflamatórios não esteroidais (AINEs) e opioides em casos mais graves.
Em modelos pré-clínicos, o CBD exerce um efeito analgésico por meio de diferentes vias de administração. Em um modelo de OA canina espontânea, o CBD aumentou a mobilidade dos cães e reduziu a dor, enquanto nenhum efeito colateral foi observado, Gamble et al. demonstraram aumento da fosfatase alcalina durante o tratamento com CBD [ 81 , 86] Em modelos de OA de roedores, a doença é geralmente induzida por injeção intra-articular (ia) de monoiodoacetato de sódio (MIA). Em ratos com osteoartrite, a administração de CBD diminui de maneira dependente da dose a taxa de disparo aferente da articulação. Além disso, foi observado um aumento no limiar de retirada da pata e na sustentação de peso. Um antagonista de TRPV1, SB-366791, inibiu significativamente o efeito analgésico do CBD em relação ao limiar de retirada da pata traseira, mas não teve um efeito significativo no peso. O CBD também reduziu a inflamação local ao diminuir os leucócitos rolantes e aderentes. O efeito anti-rolamento de CBD em 30 min foi bloqueado por antagonistas de CB2 e TRPV1, mas não por um antagonista de CB1. O efeito anti-aderência foi bloqueado apenas por SB-366791. A administração profilática de CBD evitou o desenvolvimento de dor nas articulações e exerceu um efeito neuroprotetor [87 ]. Em um modelo de articulação do joelho monoartrítico induzido por adjuvante de Freund completo, o gel de CBD transdérmico aplicado por 4 dias reduziu o inchaço da articulação de forma dependente da dose, pontuações de postura dos membros, espessamento da membrana sinovial e dor em animais. Além disso, os fatores pró-inflamatórios (peptídeo relacionado ao gene da calcitonina ou OX42) foram reduzidos na medula espinhal e nos gânglios da raiz dorsal (TNFα) [ 9 ]. Em uma artrite induzida por colágeno de tipo II de murino, a administração diária ip ou oral de CBD reduziu a progressão da doença e bloqueou os aumentos induzidos por LPS no TNFα sérico. A cultura in vitro de células sinoviais coletadas de camundongos tratados com CBD liberou TNFα diminuído em comparação com células coletadas de animais de controle. O CBD in vitro também inibiu a liberação de espécies reativas de oxigênio por neutrófilos estimulados por Zymosan [ 88] O estudo mais recente de Lowin et al. mostraram que em cultura humana in vitro de fibroblastos sinoviais de artrite reumatoide, o CBD aumenta os níveis de cálcio intracelular, reduz a viabilidade celular e a produção de IL-6 / interleucina 8 (IL-8) / MMP-3. Um antagonista de TRPA1, mas não TRPV1, reduziu os efeitos do CBD. O efeito foi potencializado pelo pré-tratamento com TNFα, que pode sugerir que o CBD tem como alvo preferencial os fibroblastos sinoviais pró-inflamatórios (ativados), sugerindo potencial atividade antiartrítica [ 89 ]. Resultados semelhantes do trabalho de Winklmayr et al. em uma cultura de condrócitos humanos in vitro mostrou que concentrações de CBD maiores que 4 μM diminuíram a viabilidade celular e aumentaram a atividade da caspase 3/7, Ca 2+ elevadoe 1/2 fosforilação de quinases reguladas por sinal extracelular e população celular apoptótica aumentada. Este efeito foi mediado pelo receptor CB1, uma vez que AM251 inibiu o influxo de Ca 2+ e reduziu os efeitos tóxicos do CBD [ 90 ].
3.4. Outros modelos de dor
Estudos individuais indicam um papel potencialmente benéfico para o CBD em vários modelos animais de doenças. A injeção sistêmica (ip) de CBD reduziu a alodinia mecânica e reverteu a preferência de lugar condicional produzida pelo bloqueio de nervo periférico em um modelo de rato de dor de incisão. Além disso, a injeção direta de CBD no córtex cingulado anterior rostral produziu um efeito dependente da dose semelhante [ 91 ]. Em um modelo de rato de dor miofascial (induzida por injeção intramuscular de fator de crescimento do nervo), a injeção intramuscular de CBD ou canabinol (CBN) diminuiu a sensibilização mecânica e aumentou o limiar mecânico dos mecanorreceptores do músculo masseter [ 92 ]. O CBD também pode aumentar a antinocicepção induzida por morfina. Em modelos animais em que n -metil- dA superatividade do receptor de aspartato (NMDA) desempenha um papel crucial (atenuação de analgesia opióide, síndrome convulsiva induzida por NMDA e acidente vascular cerebral isquêmico), injeção intracerebroventricular (icv) de CBD intensificada por morfina evocada antinocicepção supraespinal, síndrome convulsiva induzida por NMDA mitigada reduziu o tamanho do infarto causado pela oclusão da artéria cerebral média unilateral permanente. Este efeito estava ausente em camundongos knock-out para receptor sigma-1 (σ1R) e foi reduzido pelos agonistas σ1R PRE084 e PPCC [ 93] Neelakantan et al. demonstraram que mecanismos distintos de ação podem fundamentar as interações entre o CBD e a morfina nos diferentes ensaios comportamentais. A morfina por si só diminuiu as respostas nociceptivas em todos os três modelos de dor testados (alongamento estimulado por ácido acético, operante diminuído por ácido acético respondendo por alimentos palatáveis e nocicepção térmica da placa quente), enquanto que o CBD sozinho produziu um efeito antinociceptivo apenas no estimulado por ácido acético modelo de alongamento. No entanto, a combinação de CBD e morfina produziu efeitos sinérgicos na reversão do comportamento de alongamento estimulado por ácido acético, mas efeitos subaditivos no ensaio nociceptivo térmico da placa quente e o operante diminuído com ácido acético respondendo ao ensaio de alimentos palatáveis [ 94] Em um modelo de camundongo com doença de Parkinson induzida por 6-hidroxidopamina, o CBD exerceu efeitos analgésicos aumentando a ligação da anandamida aos receptores CB1 e TRPV1. O URB597, um inibidor FAAH relativamente seletivo, potencializou o efeito do CBD, o bloqueio do CB1 (por AM251) inibiu o efeito do CBD e o antagonismo do receptor TRPV1 pela capsazepina aumentou o efeito antinociceptivo do CBD [ 95 ]. Em um modelo de camundongo com hiperalgesia da córnea, o CBD produziu efeitos antinociceptivos e reduziu a infiltração de neutrófilos em camundongos de tipo selvagem e nocaute para CB2. O efeito do CBD foi bloqueado por um antagonista do receptor 5HT1a, WAY100635, em camundongos do tipo selvagem, indicando o envolvimento dos receptores 5-HT1a e CB2 nas ações analgésicas e antiinflamatórias [ 8] No entanto, Finn et al. provaram que o CBD sozinho não reduziu a nocicepção em um modelo de rato de dor persistente, ao contrário do Δ9-THC, morfina e suas combinações, e não modulou os efeitos antinociceptivos do Δ9-THC '[ 96 ].
3,5. Estudos clínicos
Os efeitos positivos do CBD foram confirmados há muitos anos [ 97 , 98 , 99 ], encorajando os ensaios clínicos. O CBD provou ser seguro e causar apenas efeitos adversos leves em humanos (por exemplo, ataxia, sedação, náusea, dor de cabeça ou diminuição do apetite) [ 100 , 101 , 102 , 103 ]. Um gel transdérmico contendo CBD em pacientes com dor neuropática periférica atenuou a dor, bem como sensações de frio e coceira [ 104] O CBD pode ser usado clinicamente sozinho ou em combinação com outros canabinóides. Epidiolex, um medicamento contendo CBD puro, é indicado para o tratamento de convulsões associadas à síndrome de Lennox Gastaut, síndrome de Dravet ou complexo de esclerose tuberosa em pacientes com 1 ano de idade ou mais. Na epilepsia resistente ao tratamento, o CBD reduziu a frequência das crises em crianças e adultos [ 105 ]. Na síndrome de Lennox-Gestaut, uma forma rara e grave de epilepsia com início na infância, o CBD oral reduziu a frequência das convulsões e melhorou as condições gerais dos pacientes, mas desencadeou efeitos adversos (sonolência, diminuição do apetite, diarreia; mais grave em grupos de doses mais altas) [ 106 , 107] O CBD mostrou resultados semelhantes para o tratamento da síndrome de Dravet, uma epilepsia resistente a medicamentos que começa durante o primeiro ano de vida. O CBD diminuiu as crises motoras principais e melhorou a condição geral dos pacientes [ 108 , 109 ].
Em um estudo de pacientes com dor crônica por Caparo et al., Géis contendo 15,7 mg de CBD, 0,5 mg de Δ9-THC, 0,3 mg de canabidivarina, 0,9 mg de ácido canabidiólico, 0,8 mg de canabicromo e> 1% de mistura de terpeno botânico causaram uso reduzido de opióides (em 53% dos pacientes) e melhorou a qualidade de vida e sono após 8 semanas de tratamento com canabinóide [ 110 ]. No entanto, em um estudo que investigou três drogas contendo CBD- e Δ9-THC (Bedrocan 22,4 mg Δ9-THC + <1 mg CBD; Bediol 13,4 mg Δ9-THC + 17,8 mg CBD; Bedrolite 18,4 mg CBD + <1 mg Δ9- THC), nenhum dos tratamentos teve um efeito maior do que o placebo nas respostas espontâneas ou elétricas à dor. Drogas contendo Δ9-THC aumentaram o limiar de dor à pressão, enquanto o CBD aumentou as concentrações plasmáticas de Δ9-THC [ 111 ].
A maioria dos estudos clínicos descreve a eficácia da coadministração de CBD e Δ9-THC, geralmente em doses de 2,5 mg de CBD e 2,7 mg de Δ9-THC em spray para mucosa oral, com períodos de tratamento variando de uma a várias semanas. Após as sessões de tratamento, os pacientes relataram redução da dor, melhora da qualidade do sono e redução da insônia e fadiga [ 112 , 113 , 114 , 115 ]. Um dos produtos registrados contendo CBD mais bem estudados é o Sativex ®(Nabiximóis), contendo as doses mencionadas de CBD e Δ9-THC. Estudos clínicos demonstraram sua eficácia na atenuação da dor em diversas doenças. Foi comprovado que atenua a dor neuropática e melhora a qualidade de vida em pacientes que sofrem de várias doenças, por exemplo, esclerose múltipla, câncer ou artrite reumatóide [ 116 , 117 , 118 , 119 ]. Lichtman et al. provou que os pacientes norte-americanos (mas não os pacientes do resto do mundo) experimentaram benefícios significativos com os nabiximóis na atenuação da dor relacionada ao câncer. Este efeito pode ser devido a doses mais baixas de opioides tomadas no início do estudo ou distribuição diferente dos tipos de dor do câncer [ 120] Por sua vez, Lynch et al. não observaram uma redução significativa na intensidade da dor na dor neuropática induzida por quimioterapia em comparação com o placebo. No entanto, cinco de 16 pacientes relataram uma redução de dois pontos ou mais na dor [ 121 ]. Um estudo de Santoro et al. mostraram que em pacientes com esclerose múltipla, tratados ou não com interferon-1β (IFN-1β), o Sativex ® diminuiu os níveis de expressão de CNR2 em células mononucleares do sangue periférico (este efeito não foi observado em pacientes que não foram tratados com IFN-1β durante o estudo ) [ 122 ].
4. Resumo
O CBD é um composto natural bem tolerado e seguro que exerce efeitos analgésicos em vários modelos animais de dor, bem como em estudos clínicos. Os estudos referenciados indicam uma influência positiva do CBD no tratamento de várias doenças em ensaios pré-clínicos e clínicos. Na maioria dos estudos em animais, o CBD demonstrou exercer efeitos analgésicos, diminuindo a hiperalgesia e a alodinia mecânica / térmica por meio de várias vias de administração. Quando coadministrado com Δ9-THC, o CBD pode reduzir a dose efetiva e diminuir os efeitos colaterais negativos do Δ9-THC [ 68 , 74 ]. No entanto, alguns estudos indicam que não há modulação dos efeitos do Δ9-THC pelo CBD [ 96] Além disso, o CBD tem potencial para atuar de forma antiinflamatória; Contudo; os efeitos não são claros. Nos modos de dor relacionados à inflamação, algumas pesquisas dão esperança para uma ação antiinflamatória do CBD, enquanto outras relataram resultados opostos. Pesquisas mais detalhadas são necessárias para esclarecer esse efeito; entretanto, o estado inflamatório nem sempre é negativo. Em estudos de artrite in vitro, o CBD promoveu apoptose de condrócitos e sinoviócitos, mas com efeitos mais fortes nas células ativadas por inflamação, o que pode ser um resultado positivo que indica atividade anti-artrítica [ 89 , 90] Os estudos discutidos indicam uma influência positiva do CBD em várias doenças; no entanto, os estudos em animais nem sempre podem ser traduzidos em resultados humanos. Também é importante lembrar que existem poucos ou nenhum estudo sobre a administração crônica de CBD em pessoas saudáveis. Apesar do fato de que existem ensaios em voluntários saudáveis que demonstram a segurança e boa tolerância do CBD, esses estudos não examinam o uso prolongado, que é comum em pessoas com doenças crônicas. Pacientes que sofrem de dores crônicas são freqüentemente forçados a tomar medicamentos continuamente por muitos anos; não é possível testar os efeitos do CBD em pessoas saudáveis por tanto tempo [ 123 , 124] Os estudos em animais com tratamento crônico com CBD duram várias semanas, até vários meses, o que pode refletir o uso prolongado em pessoas, mas as diferenças não puderam ser excluídas. Em um estudo com animais, Ignatowska-Jankowska et al. demonstraram que o tratamento repetido com CBD pode inibir a imunidade específica reduzindo o número de células T, B, T citotóxicas e T auxiliares, enquanto aumenta o número de células NK e NKT envolvidas na resposta imunológica antiviral e antitumoral inespecífica [ 125] O tratamento crônico com CBD permite que efeitos terapêuticos de longo prazo sejam alcançados, sem efeitos colaterais significativos ou desenvolvimento de tolerância. Especialmente importantes são os efeitos antiinflamatórios prolongados, que podem ter uma influência mais direta na causa do desenvolvimento da dor e, portanto, proporcionar efeito analgésico de longa duração. O tratamento agudo com CBD pode não ser suficiente para combater a causa da dor e proporcionar um efeito que dura várias horas (dependendo do modelo da doença, dose e via de administração).
O CBD é uma substância de grande potencial terapêutico, mas atualmente é pouco estudada. Estudos de curto prazo com CBD em humanos ilustram baixa toxicidade e efeitos adversos leves. No entanto, não se sabe quais efeitos serão causados pelas “gomas de CBD” ou “água CBD”, cada vez mais oferecidas pelos fabricantes a um público amplo. A farmacologia do CBD não é tão clara quanto o Δ9-THC, onde o mecanismo de ação exato é conhecido. Aqui, ainda temos muito que aprender.
Devido ao seu complexo perfil farmacológico, os efeitos observados com a administração do CBD variam e podem ser dependentes do estado. Estudos in vivo revelaram papéis significativos de vários alvos moleculares em diferentes modelos, a saber, 5HT1a, CB1, CB2, TRPV1, α3 GlyRs, adenosina A1 e TRPA1. Esses alvos muitas vezes não foram replicados em vários modelos, sugerindo a hipótese de efeitos dependentes do estado do CBD. Para apoiar ainda mais essa hipótese, enfatizamos as interações do CBD com o sistema endocanabinoide. O CBD pode atuar como um agonista indireto dos receptores canabinóides através do aumento do tônus endocanabinóide [ 95 ], mais provavelmente através da inibição do FABP [ 43 , 44 ], mas por outro lado, pode antagonizar diretamente o receptor CB1 [ 14] Da mesma forma, a atividade do CBD para o receptor CB2 é muito complexa, incluindo agonismo parcial e modulação alostérica negativa [ 14 ]. Para complicar ainda mais a questão, sabe-se que a ação parcial do agonista depende da expressão do receptor, densidade e atividade tônica do sistema; portanto, pode variar em diferentes tecidos e em diferentes condições [ 126], apoiando ainda mais nossa hipótese dependente do estado. Sem surpresa, muitos dos alvos mencionados acima incluem canais iônicos, como os receptores TRPV1 e TRPA1 ou α3 GlyRs. Além disso, vale a pena estudar o papel dos receptores de adenosina nos efeitos antiinflamatórios e antinociceptivos do CBD, pois o CBD é um potente inibidor da recaptação da adenosina; portanto, os receptores de adenosina podem ser o nodo de ação do CBD. Além disso, seria interessante ver o papel de outros alvos moleculares de CBD envolvidos na transmissão da dor, particularmente receptores de dopamina D2 ou GPRs entre GPCRs e, mais importante, vários alvos ionotrópicos, como canais de cálcio ou sódio, receptores GABA, 5HT3A ou receptores α7nACh.
Em comparação com o Δ9-THC, o CBD tem menos efeitos colaterais indesejados e são mais brandos. Esses resultados fornecem esperança para o uso bem-sucedido do CBD na clínica no futuro; entretanto, mais estudos são necessários para a elucidação precisa dos mecanismos de ação do CBD. Esperamos que esta revisão, juntamente com as tabelas de dados sobre a farmacologia do CBD, possa facilitar a compreensão do potencial do CBD em várias condições de dor. É importante ressaltar que uma consideração séria deve ser aplicada às possíveis interações medicamentosas devido a uma proporção significativa da interação do CBD com as isoformas do citocromo P450.
Materiais Suplementares
Os materiais complementares podem ser encontrados em https://www.mdpi.com/1422-0067/21/22/8870/s1 . Os materiais incluem uma tabela que resume os resultados relativos à ação do CBD na pesquisa da dor e uma tabela CSV contendo os dados farmacológicos do CBD. Se você estiver disposto a usar as tabelas para análises posteriores, cite este artigo.
Contribuições do autor
Conceituação, JM e MB; metodologia, JM e MB; investigação, JM e MB; curadoria de dados, JM e MB; redação - preparação do rascunho original, JM e MB; redação - revisão e edição, JM, MB e KS; visualização, JM e MB; supervisão, KS; administração de projetos, KS; aquisição de financiamento, KS Todos os autores leram e concordaram com a versão publicada do manuscrito.
Financiamento
Este trabalho foi apoiado pelo National Science Centre, Poland pela bolsa OPUS12 UMO-2016/23 / B / NZ7 / 01143 e por fundos estatutários departamentais (Maj Institute of Pharmacology, Polish Academy of Sciences).
Conflitos de interesse
Os autores declaram não haver conflito de interesses.
Abreviações
| Δ9-THC | Δ 9 tetrahidrocanabinol |
| Δ9-THC-BDS | Substância medicamentosa botânica Δ9-tetrahidrocanabinol |
| σ1R | Receptor Sigma-1 |
| 2-AG | 2-araquidonoilglicerol |
| 5HT1a | Receptor de serotonina 1A |
| AANAT | Aralquilamina N-acetiltransferase |
| ABCC1 | Proteína 1 associada à resistência a múltiplas drogas |
| ABCG2 | Cassete de ligação de ATP membro da superfamília G 2 |
| UM GATO | Acil-CoA colesterina aciltransferase |
| AEA | Anandamida |
| ACAMPAMENTO | Monofosfato de adenosina cíclico |
| CB | Receptor de canabinóide |
| CBD | Canabidiol |
| CBDA | Ácido canabidiólico |
| CBD – BDS | Substância medicamentosa botânica-canabidiol |
| CBC | Canabichromene |
| CBN | Canabinol |
| CCI | Lesão de constrição crônica |
| CFA | Adjuvante de Freund completo |
| CHO | Células de ovário de hamster chinês |
| CYPs | Superfamília do citocromo P450 |
| DOR | receptor δ-opioide |
| EAE | Encefalite autoimune experimental |
| ENT | Transportador de nucleosídeo equilibrado |
| EROD | Etoxiresorufina-O-desetilase |
| FAAH | Amida hidrolase de ácido graxo |
| GCSF | Fator estimulador de colônia de granulócitos |
| GlyRs | Receptores de glicina |
| GPCR | Receptor acoplado à proteína G |
| GPR | Receptor acoplado à proteína G órfã |
| GTP | Guanosina 5′-O- [gama-tio] trifosfato |
| HEK293 | Células 293 de rim embrionário humano |
| HPLC | Cromatografia líquida de alta performance |
| HTRF | Fluorescência Resolvida com Tempo Homogêneo |
| I a | Intra-articular |
| EU FAÇO | Indoleamina-pirrol 2,3-dioxigenase |
| IFN-γ | Interferon- γ |
| IFN-1β | Interferon-1β |
| IL | Interleucina |
| ip | Intra-peritoneal |
| LOXs | Lipooxigenases |
| LPS | Lipopolissacarídeo |
| MIA | Monoiodoacetato de sódio |
| MOR | receptor μ -opioide |
| NAM | Modulador alostérico negativo |
| NBD-estearato | Ácido 12- N- metil- (7-nitrobenz-2-oxa-1,3-diazo) aminostárico |
| NMDA | Receptor N- metil- d- aspartato |
| AINEs | Antiinflamatórios não esteróides |
| OA | Osteoartrite |
| PAC | Paclitaxel |
| PAG | Cinza periaquedutal |
| PAM | Moduladores alostéricos positivos |
| PBMC | Célula mononuclear de sangue periférico |
| PLA2 | Fosfolipase A2 |
| PPRγ | Receptor gama ativado por proliferador de peroxissoma |
| DEZ | Estimulação nervosa elétrica transcutânea |
| TNFα | Fator de necrose tumoral α |
| TRP | Canal potencial receptor transitório |
| VDAC1 | Canal 1 de ânion dependente de voltagem |
Referências
- Russo, EB História da Cannabis e seus preparativos na Saga, Ciência e Sobriquet. Chem. Biodivers. 2007 , 4 , 1614–1648.
- Ladha, KS; Ajrawat, P .; Yang, Y .; Clarke, H. Understanding the Medical Chemistry of the Cannabis Plant is Critical to Guiding Real World Clinical Evidence. Molecules 2020 , 25 , 4042.
- Toczek, M .; Malinowska, B. Tônus endocanabinoide aprimorado como um alvo potencial da farmacoterapia. Life Sci. 2018 , 204 , 20–45.
- Adams, R .; Hunt, M. Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. I. J. Am. Chem. Soc. 1940 , 62 , 196–200.
- Mechoulam, R .; Shani, A .; Edery, H .; Grunfeld, Y. Chemical basis of hashish activity. Science 1970 , 169 , 611–612.
- Crippa, JA; Guimarães, FS; Campos, AC; Zuardi, AW Investigação translacional do potencial terapêutico do canabidiol (CBD): Rumo a uma nova era. Frente. Immunol. 2018 , 9 .
- Iffland, K .; Grotenhermen, F. An Update on Safety and Side Effects of Cannabidiol: A Review of Clinical Data and Relevant Animal Studies. Cannabis Cannabinoid Res. 2017 , 2 , 139–154.
- Thapa, D .; Cairns, EA; Szczesniak, AM; Toguri, JT; Caldwell, MD; Kelly, MEM Os canabinóides Δ8THC, CBD e HU-308 agem por meio de receptores distintos para reduzir a dor e a inflamação na córnea. Cannabis Cannabinoid Res. 2018 , 3 , 11–20.
- Hammell, DC; Zhang, LP; Ma, F .; Abshire, SM; McIlwrath, SL; Stinchcomb, AL; Westlund, KN O canabidiol transdérmico reduz a inflamação e os comportamentos relacionados à dor em um modelo de rato com artrite. EUR. J. Pain 2016 , 20 , 936–948.
- Kozela, E .; Lev, N .; Kaushansky, N .; Eilam, R .; Rimmerman, N .; Levy, R .; Ben-Nun, A .; Juknat, A .; Vogel, Z. O canabidiol inibe as células T patogênicas, diminui a ativação da microglia espinhal e melhora a doença semelhante à esclerose múltipla em camundongos C57BL / 6. Br. J. Pharmacol. 2011 , 163 , 1507–1519.
- Pan, H .; Mukhopadhyay, P .; Rajesh, M .; Patel, V .; Mukhopadhyay, B .; Gao, B .; Haskó, G .; Pacher, P. O canabidiol atenua a nefrotoxicidade induzida pela cisplatina ao diminuir o estresse oxidativo / nitrosativo, a inflamação e a morte celular. J. Pharmacol. Exp. Ther. 2009 , 328 , 708-714.
- Costa, B .; Trovato, AE; Comelli, F .; Giagnoni, G .; Colleoni, M. O canabidiol constituinte não psicoativo da cannabis é um agente terapêutico eficaz por via oral na dor inflamatória e neuropática crônica em ratos. EUR. J. Pharmacol. 2007 , 556 , 75–83.
- Thomas, BF; Gilliam, AF; Burch, DF; Roche, MJ; Seltzman, HH Comparative receptor binding analysis of cannabinoid agonists and antagonists. J. Pharmacol. Exp. Ther. 1998 , 285 , 285–292.
- Tham, M .; Yilmaz, O .; Alaverdashvili, M .; Kelly, MEM; Denovan-Wright, EM; Laprairie, RB Farmacologia alostérica e ortostérica de canabidiol e canabidiol-dimetilheptilo nos receptores canabinóides tipo 1 e tipo 2. Br. J. Pharmacol. 2019 , 176 , 1455–1469.
- Showalter, VM; Compton, DR; Martin, BR; Abood, ME Avaliação da ligação em uma linha celular transfectada que expressa um receptor canabinoide periférico (CB2): Identificação de ligantes seletivos do subtipo de receptor de canabinoide. J. Pharmacol. Exp. Ther. 1996 , 278 , 989–999.
- Thomas, A .; Ross, RA; Saha, B .; Mahadevan, A .; Razdan, RK; Pertwee, RG 6 ″ -Azidohex-2 ″ -ine-canabidiol: Um potencial antagonista competitivo do receptor de canabinoide CB1. EUR. J. Pharmacol. 2004 , 487 , 213–221.
- Thomas, A .; Baillie, GL; Phillips, AM; Razdan, RK; Ross, RA; Pertwee, RG Canabidiol exibe uma potência inesperadamente alta como um antagonista dos agonistas dos receptores CB 1 e CB 2 in vitro. Br. J. Pharmacol. 2007 , 150 , 613-623.
- Martínez-Pinilla, E .; Varani, K .; Reyes-Resina, I .; Angelats, E .; Vincenzi, F .; Ferreiro-Vera, C .; Oyarzabal, J .; Canela, EI; Lanciego, JL; Nadal, X .; et al. Os estudos de ligação e sinalização revelam um sítio alostérico potencial para canabidiol em receptores de canabinóide CB2. Frente. Pharmacol. 2017 , 8 , 744.
- Laprairie, RB; Bagher, AM; Kelly, MEM; Denovan-Wright, EM A sinalização do receptor canabinóide tipo 1 enviesada influencia a viabilidade neuronal em um modelo de cultura de células de doenças de Huntington. Mol. Pharmacol. 2016 , 89 , 364-375.
- Navarro, G .; Reyes-Resina, I .; Rivas-Santisteban, R .; Sánchez de Medina, V .; Morales, P .; Casano, S .; Ferreiro-Vera, C .; Lillo, A .; Aguinaga, D .; Jagerovic, N .; et al. O canabidiol distorce o agonismo tendencioso nos receptores canabinoides CB1 e CB2 com menor efeito nos complexos de heterorreceptores CB1-CB2. Biochem. Pharmacol. 2018 , 157 , 148–158.
- Russo, EB; Burnett, A .; Hall, B .; Parker, KK Agonistic properties of cannabidiol at 5-HT1a receptors. Neurochem. Res. 2005 , 30 , 1037–1043.
- Rock, EM; Bolognini, D .; Limebeer, CL; Cascio, MG; Anavi-Goffer, S .; Fletcher, PJ; Mechoulam, R .; Pertwee, RG; Parker, LA Canabidiol, um componente não psicotrópico da cannabis, atenua o vômito e o comportamento do tipo náusea por meio do agonismo indireto dos autorreceptores somatodendríticos 5-HT 1A no núcleo dorsal da rafe. Br. J. Pharmacol. 2012 , 165 , 2620–2634.
- Ryberg, E .; Larsson, N .; Sjögren, S .; Hjorth, S .; Hermansson, N.-O .; Leonova, J .; Elebring, T .; Nilsson, K .; Drmota, T .; Greasley, PJ O receptor órfão GPR55 é um novo receptor canabinóide. Br. J. Pharmacol. 2007 , 152 , 1092–1101.
- Lauckner, JE; Jensen, JB; Chen, HY; Lu, HC; Hille, B .; Mackie, K. GPR55 é um receptor canabinóide que aumenta o cálcio intracelular e inibe a corrente M. Proc. Natl. Acad. Sci. USA 2008 , 105 , 2699–2704.
- Henstidge, CM; Balenga, NAB; Ford, LA; Ross, RA; Waldhoer, M .; Irving, AJ O ligante GPR55 L-α-lisofosfatidilinositol promove a sinalização de Ca 2+ dependente de RhoA e a ativação de NFAT. FASEB J. 2009 , 23 , 183–193.
- Kapur, A .; Zhao, P .; Sharir, H .; Bai, Y .; Caron, MG; Barak, LS; Abood, ME Resposta atípica do receptor órfão GPR55 a ligantes canabinóides. J. Biol. Chem. 2009 , 284 , 29817–29827.
- Laun, AS; Song, ZH GPR3 e GPR6, novos alvos moleculares para o canabidiol. Biochem. Biophys. Res. Comum. 2017 , 490 , 17–21.
- Brown, KJ; Laun, AS; Song, ZH Cannabidiol, um novo agonista inverso para GPR12. Biochem. Biophys. Res. Comum. 2017 , 493 , 451–454.
- Laun, AS; Shrader, SH; Brown, KJ; Song, ZH GPR3, GPR6 e GPR12 como novos alvos moleculares: suas funções biológicas e interação com o canabidiol. Acta Pharmacol. Pecado. 2019 , 40 , 300–308.
- Bian, YM; Ele, XB; Jing, YK; Wang, LR; Wang, JM; Xie, XQ Análise de farmacologia de sistemas computacionais de canabidiol: Uma combinação de análise de rede de base de conhecimento e quimiogenômica e modelagem e simulação integrada in silico. Acta Pharmacol. Pecado. 2019 , 40 , 374–386.
- De Petrocellis, L .; Ligresti, A .; Moriello, AS; Allarà, M .; Bisogno, T .; Petrosino, S .; Stott, CG; Di Marzo, V. Effects of canabinoids and cannabinoid-enriquecido Cannabis extract on TRP channel and endocannabinoid metabolic enzmes. Br. J. Pharmacol. 2011 , 163 , 1479–1494.
- De Petrocellis, L .; Vellani, V .; Schiano-Moriello, A .; Marini, P .; Magherini, PC; Orlando, P .; Di Marzo, V. Canabinóides derivados de plantas modulam a atividade dos canais de receptor potencial transiente da anquirina tipo-1 e melastatina tipo-8. J. Pharmacol. Exp. Ther. 2008 , 325 , 1007–1015.
- Bisogno, T .; Hanuš, L .; De Petrocellis, L .; Tchilibon, S .; Ponde, DE; Brandi, I .; Moriello, AS; Davis, JB; Mechoulam, R .; Di Marzo, V. Alvos moleculares para canabidiol e seus análogos sintéticos: Efeito sobre os receptores vanilóides VR1 e sobre a captação celular e hidrólise enzimática da anandamida. Br. J. Pharmacol. 2001 , 134 , 845–852.
- Qin, N .; Neeper, MP; Liu, Y .; Hutchinson, TL; Lubin, ML; Flores, CM TRPV2 é ativado pelo canabidiol e medeia a liberação de CGRP em neurônios do gânglio da raiz dorsal de ratos cultivados. J. Neurosci. 2008 , 28 , 6231–6238.
- Nabissi, M .; Morelli, MB; Santoni, M .; Santoni, G. Triggering of the TRPV2 channel by canabidiol sensibiliza glioblastoma cells to cytotoxic chemotherapeutic agents. Carcinogenesis 2013 , 34 , 48-57.
- Yang, KH; Galadari, S .; Isaev, D .; Petroianu, G .; Shippenberg, TS; Oz, M. O canabinóide não psicoativo canabidiol inibe as correntes mediadas pelo receptor 5-hidroxitriptamina3A em oócitos de xenopus laevis. J. Pharmacol. Exp. Ther. 2010 , 333 , 547–554.
- Mahgoub, M .; Keun-Hang, SY; Sydorenko, V .; Ashoor, A .; Kabbani, N .; Al Kury, L .; Sadek, B .; Howarth, CF; Isaev, D .; Galadari, S .; et al. Efeitos do canabidiol na função dos receptores α7-nicotínicos da acetilcolina. EUR. J. Pharmacol. 2013 , 720 , 310–319.
- Bakas, T .; van Nieuwenhuijzen, PS; Devenish, SO; McGregor, IS; Arnold, JC; Chebib, M. The direct actions of canabidiol and 2-arachidonoyl glycerol at GABAA receptors. Pharmacol. Res. 2017 , 119 , 358–370.
- Ahrens, J .; Demir, R .; Leuwer, M .; De La Roche, J .; Krampfl, K .; Foadi, N .; Karst, M .; Haeseler, G. O canabinóide não psicotrópico canabidiol modula e ativa diretamente a função do receptor de alfa-1 e alfa-1-beta glicina. Pharmacology 2009 , 83 , 217–222.
- Ross, HR; Napier, I .; Connor, M. Inhibition of recombinant human human cálcio T-type channels by Δ9-tetrahydrocannabinol and cannabidiol. J. Biol. Chem. 2008 , 283 , 16124–16134.
- Ghovanloo, MR; Shuart, NG; Mezeyova, J .; Dean, RA; Ruben, PC; Goodchild, SJ Inhibitory effects of canabidiol on volt-dependente sodium current. J. Biol. Chem. 2019 , 293 , 16546–16558.
- Rimmerman, N .; Ben-Hail, D .; Porat, Z .; Juknat, A .; Kozela, E .; Daniels, MP; Connelly, PS; Leishman, E .; Bradshaw, HB; Shoshan-Barmatz, V .; et al. Modulação direta do canal da membrana mitocondrial externa, canal aniônico dependente de voltagem 1 (VDAC1) pelo canabidiol: Um novo mecanismo para morte celular induzida por canabinoides. Cell Death Dis. 2013 , 4 , e949.
- Elmes, MW; Kaczocha, M .; Berger, WT; Leung, K .; Ralph, BP; Wang, L .; Sweeney, JM; Miyauchi, JT; Tsirka, SE; Ojima, I .; et al. Proteínas de ligação de ácidos graxos (FABPs) são portadores intracelulares para Δ 9 -Tetrahidrocanabinol (THC) e Canabidiol (CBD). J. Biol. Chem. 2015 , 290 , 8711–8721.
- Huang, H .; McIntosh, AL; Martin, GG; Landrock, D .; Chung, S .; Landrock, KK; Dangott, LJ; Li, S .; Kier, AB; Schroeder, F. FABP1: A Novel Hepatic Endocannabinoid and Cannabinoid Binding Protein. Biochemistry 2016 , 55 , 5243–5255.
- Leishman, E .; Manchanda, M .; Thelen, R .; Miller, S .; Mackie, K .; Bradshaw, HB Cannabidiol's Upregulation of N-acyl Ethanolamines in the Central Nervous System Requer N-acyl Phosphatidyl Ethanolamine-specific Phospholipase D. Cannabis Cannabinoid Res. 2018 , 3 , 228–241.
- Leweke, FM; Piomelli, D .; Pahlisch, F .; Muhl, D .; Gerth, CW; Hoyer, C .; Klosterkötter, J .; Hellmich, M .; Koethe, D. Cannabidiol aumenta a sinalização da anandamida e alivia os sintomas psicóticos da esquizofrenia. Tradução Psychiatry 2012 , 2 , e94.
- Carrier, EJ; Auchampach, JA; Hillard, CJ Inibição de um transportador de nucleosídeo equilibrado por canabidiol: Um mecanismo de imunossupressão canabinóide. Proc. Natl. Acad. Sci. USA 2006 , 103 , 7895–7900.
- Mijangos-Moreno, S .; Poot-Aké, A .; Arankowsky-Sandoval, G .; Murillo-Rodríguez, E. A injeção intra-hipotalâmica de canabidiol aumenta os níveis extracelulares de adenosina no núcleo accumbens de ratos. Neurosci. Res. 2014 , 84 , 60–63.
- Takeda, S .; Usami, N .; Yamamoto, I .; Watanabe, K. Cannabidiol-2 ', 6'-dimetil éter, um derivado de canabidiol, é um inibidor de 15-lipoxigenase altamente potente e seletivo. Drug Metab. Dispos. 2009 , 37 , 1733–1737.
- Wheal, AJ; Cipriano, M .; Fowler, CJ; Randall, MD; O'Sullivan, SE O canabidiol melhora o vasorrelaxamento em ratos gordos diabéticos Zucker através da ativação da ciclooxigenase. J. Pharmacol. Exp. Ther. 2014 , 351 , 457–466.
- Evans, AT; Formukong, E .; Evans, FJ Activation of phospholipase A2 by cannabinoids. Falta de correlação com os efeitos do SNC. FEBS Lett. 1987 , 211 , 119-122.
- Fišar, Z .; Singh, N .; Hroudová, J. Cannabinoid-induzidas alterações na respiração de mitocôndrias cerebrais. Toxicol. Lett. 2014 , 231 , 62–71.
- Koch, M .; Dehghani, F .; Habazettl, I .; Schomerus, C .; Korf, HW Canabinoides atenuam a biossíntese de melatonina induzida por norepinefrina na glândula pineal de rato, reduzindo a atividade da arilalquilamina N-acetiltransferase sem envolvimento de receptores de canabinoides. J. Neurochem. 2006 , 98 , 267–278.
- Jenny, M .; Santer, E .; Pirich, E .; Schennach, H .; Fuchs, D. Δ9-tetraidrocanabinol e canabidiol modulam a degradação de triptofano induzida por mitogênio e a formação de neopterina em células mononucleares do sangue periférico in vitro. J. Neuroimmunol. 2009 , 207 , 75–82.
- Cornicelli, JA; Gilman, SR; Krom, BA; Kottke, BA Cannabinoids prejudica a formação de éster de colesterol em células humanas cultivadas. Arteriosclerosis 1981 , 1 , 449–454.
- Watanabe, K .; Motoya, E .; Matsuzawa, N .; Funahashi, T .; Kimura, T .; Matsunaga, T .; Arizono, K .; Yamamoto, I. Os extratos de maconha possuem efeitos semelhantes aos dos desreguladores endócrinos. Toxicology 2005 , 206 , 471–478.
- Granja, AG; Carrillo-Salinas, F .; Pagani, A .; Gómez-Cañas, M .; Negri, R .; Navarrete, C .; Mecha, M .; Mestre, L .; Fiebich, BL; Cantarero, I .; et al. Uma quinona canabigerol alivia a neuroinflamação em um modelo crônico de esclerose múltipla. J. Neuroimmune Pharmacol. 2012 , 7 , 1002–1016.
- Hegde, VL; Singh, UP; Nagarkatti, PS; Nagarkatti, M. Critical Role of Mast Cells e Peroxisome Proliferator-Activated Receptor γ na indução de células supressoras derivadas de mieloide por maconha Cannabidiol In Vivo. J. Immunol. 2015 , 194 , 5211–5222.
- Juknat, A .; Pietr, M .; Kozela, E .; Rimmerman, N .; Levy, R .; Gao, F .; Coppola, G .; Geschwind, D .; Vogel, Z. Microarray and Pathway Analysis Reveal Distinct Mechanisms Underlying Cannabinoid-Mediated Modulation of LPS-Induced Activation of BV-2 Microglial Cells. PLoS ONE 2013 , 8 , e61462.
- McPartland, JM; Duncan, M .; Di Marzo, V .; Pertwee, RG. Canabidiol e Δ9-tetrahidrocanabivarina são moduladores negativos do sistema endocanabinoide? Uma revisão sistemática. Br. J. Pharmacol. 2015 , 172 , 737–753.
- Maione, S .; Piscitelli, F .; Gatta, L .; Vita, D .; De Petrocellis, L .; Palazzo, E .; De Novellis, V .; Di Marzo, V. Canabinóides não psicoativos modulam a via descendente da antinocicepção em ratos anestesiados por meio de vários mecanismos de ação. Br. J. Pharmacol. 2011 , 162 , 584–596.
- Britch, SC; Wiley, JL; Yu, Z .; Clowers, BH; Craft, RM Cannabidiol-Δ9-tetrahydrocannabinol interações na dor aguda e atividade locomotora. Drug Alcohol Depend. 2017 , 175 , 187–197.
- Greene, Nova Zelândia; Wiley, JL; Yu, Z .; Clowers, BH; Craft, RM Cannabidiol modulation of antinociceptive tolerance to Δ9-tetrahydrocannabinol. Psychopharmacology 2018 , 235 , 3289–3302.
- Gonçalves, TCT; Londe, AK; Albano, RIP; De Araújo Júnior, AT; De Aguiar Azeredo, M .; Biagioni, AF; Vasconcellos, THF; Dos Reis Ferreira, CM; Teixeira, DG; De Souza Crippa, JA; et al. Os mecanismos mediados pelo canabidiol e por peptídeos opióides endógenos modulam a antinocicepção induzida por eletroestimulação transcutânea do sistema nervoso periférico. J. Neurol. Sci. 2014 , 347 , 82-89.
- Abraham, AD; Leung, EJY; Wong, BA; Rivera, ZMG; Kruse, LC; Clark, JJ; Land, BB Os canabinóides consumidos por via oral fornecem alívio duradouro da alodinia em um modelo de camundongo com dor neuropática crônica. Neuropsychopharmacology 2020 , 45 , 1105-1114.
- Xiong, W .; Cui, T .; Cheng, K .; Yang, F .; Chen, SR; Willenbring, D .; Guan, Y .; Pan, HL; Ren, K .; Xu, Y .; et al. Os canabinoides suprimem a dor inflamatória e neuropática, tendo como alvo os receptores α3 glicina. J. Exp. Med. 2012 , 209 , 1121–1134.
- Vigil, JM; Montera, MA; Pentkowski, NS; Diviant, JP; Orozco, J .; Ortiz, AL; Rael, LJ; Westlund, KN A eficácia terapêutica do óleo de cânhamo de espectro completo usando um modelo de dor neuropática crônica. Life 2020 , 10 , 69.
- Casey, SL; Atwal, N .; Vaughan, CW Cannabis constituent synergy in a mouse neuropathic pain model. Pain 2017 , 158 , 2452–2460.
- Li, H .; Kong, W .; Chambers, CR; Yu, D .; Ganea, D .; Tuma, RF; Ward, SJ O canabidiol fitocanabinóide não psicoativo (CBD) atenua mediadores pró-inflamatórios, infiltração de células T e sensibilidade térmica após lesão da medula espinhal em camundongos. Célula. Immunol. 2018 , 329 , 1–9.
- Linher-Melville, K .; Zhu, YF; Sidhu, J .; Parzei, N .; Shahid, A .; Seesankar, G .; Louco.; Wang, Z .; Zacal, N .; Sharma, M .; et al. Avaliação da eficácia analgésica pré-clínica de formas de óleo derivadas naturalmente e administradas por via oral de Δ9-tetrahidrocanabinol (THC), canabidiol (CBD) e sua combinação 1: 1. PLoS ONE 2020 , 15 , e0234176
- De Gregorio, D .; McLaughlin, RJ; Posa, L .; Ochoa-Sanchez, R .; Enns, J .; Lopez-Canul, M .; Aboud, M .; Maione, S .; Comai, S .; Gobbi, G. Cannabidiol modula a transmissão serotonérgica e reverte a alodinia e o comportamento semelhante à ansiedade em um modelo de dor neuropática. Pain 2019 , 160 , 136-150.
- Ward, SJ; Ramirez, MD; Neelakantan, H .; Walker, EA O canabidiol previne o desenvolvimento de alodinia ao frio e mecânica em camundongos c57bl6 fêmeas tratados com paclitaxel. Anesth. Analg. 2011 , 113 , 947-950.
- Ward, SJ; McAllister, SD; Kawamura, R .; Murase, R .; Neelakantan, H .; Walker, EA O canabidiol inibe a dor neuropática induzida pelo paclitaxel por meio dos receptores 5-HT 1A sem diminuir a função do sistema nervoso ou a eficácia da quimioterapia. Br. J. Pharmacol. 2014 , 171 , 636-645.
- King, KM; Myers, AM; Soroka-Monzo, AJ; Tuma, RF; Tallarida, RJ; Walker, EA; Ward, SJ Efeitos únicos e combinados de Δ9-tetrahidrocanabinol e canabidiol em um modelo de camundongo de dor neuropática induzida por quimioterapia. Br. J. Pharmacol. 2017 , 174 , 2832–2841.
- Harris, HM; Sufka, KJ; Gul, W .; Elsohly, MA Effects of Delta-9-Tetrahydrocannabinol and Canabidiol on Cisplatin-Induced Neuropathy in Mice. Planta Med. 2016 , 82 , 1169-1172.
- Lehmann, C .; Fisher, NB; Tugwell, B .; Szczesniak, A .; Kelly, M .; Zhou, J. O tratamento experimental com canabidiol reduz a inflamação pancreática precoce no diabetes tipo 1. Clin. Hemorheol. Microcirc. 2016 , 64 , 655–662.
- Rajesh, M .; Mukhopadhyay, P .; Btkai, S .; Patel, V .; Saito, K .; Matsumoto, S .; Kashiwaya, Y .; Horvth, B .; Mukhopadhyay, B .; Becker, L .; et al. O canabidiol atenua a disfunção cardíaca, o estresse oxidativo, a fibrose e as vias de sinalização inflamatória e de morte celular na cardiomiopatia diabética. Geléia. Coll. Cardiol. 2010 , 56 , 2115–2125.
- Toth, CC; Jedrzejewski, NM; Ellis, CL; Frey, WH Cannabinoid-Mediated Modulation of Neuropathic Pain and Microglial Accumulation in a Model of Murine Tipo I Diabetic Peripheral Neuropathic Pain. Mol. Pain 2010 , 6 .
- Jesus, CHA; Redivo, DDB; Gasparin, AT; Sotomaior, BB; de Carvalho, MC; Genaro, K .; Zuardi, AW; Hallak, JEC; Crippa, JA; Zanoveli, JM; et al. O canabidiol atenua a alodinia mecânica em ratos diabéticos induzidos por estreptozotocina por meio da ativação do sistema serotonérgico por meio de receptores 5-HT1A. Brain Res. 2019 , 1715 , 156–164.
- Vasko, MR I Ia Inhibitory Interneuron Definition. Na Dor Inflamatória ; Binder, MD, Hirokawa, N., Windhorst, U., Eds .; Enciclopédia de Neurociências; Springer: Berlin / Heidelberg, Germany, 2009.
- Verrico, CD; Wesson, S .; Konduri, V .; Hofferek, CJ; Vazquez-Perez, J .; Blair, E .; Dunner, K .; Salimpour, P .; Decker, WK; Halpert, MM Um estudo randomizado, duplo-cego, controlado por placebo de canabidiol diário para o tratamento da dor da osteoartrite canina. Pain 2020 , 161 , 2191–2202.
- Britch, SC; Goodman, AG; Wiley, JL; Pondelick, AM; Craft, RM Antinociceptive and Immune Effects of Delta-9-Tetrahydrocannabinol or Canabidiol in Male Versus Female Rats with Persistent Inflammatory Pain. J. Pharmacol. Exp. Ther. 2020 , 373 , 416-428.
- Karmaus, PWF; Wagner, JG; Harkema, JR; Kaminski, NE; Kaplan, BLF Canabidiol (CBD) aumenta a inflamação pulmonar induzida por lipopolissacarídeo (LPS) em camundongos C57BL / 6. J. Immunotoxicol. 2013 , 10 , 321–328.
- Rock, EM; Limebeer, CL; Parker, LA Effect of cannabidiolic acid and ∆9-tetrahydrocannabinol on carragenina-induzida hiperalgesia e edema em um roedor modelo de dor inflamatória. Psychopharmacology 2018 , 235 , 3259-3271.
- Moreno-Martet, M .; Feliú, A .; Espejo-Porras, F .; Mecha, M .; Carrillo-Salinas, FJ; Fernández-Ruiz, J .; Guaza, C .; De Lago, E. Os efeitos modificadores da doença de uma combinação de fitocanabinóides do tipo Sativex em camundongos com encefalomielite autoimune experimental são devidos preferencialmente à ação do Δ9-tetra-hidrocanabinol através dos receptores CB1. Mult. Scler. Relat. Desordem. 2015 , 4 , 505-511.
- Gamble, LJ; Boesch, JM; Frye, CW; Schwark, WS; Mann, S .; Wolfe, L .; Brown, H .; Berthelsen, ES; Wakshlag, JJ Pharmacokinetics, Safety, and Clinical Efficacy of Cannabidiol Treatment in Osteoarthritic Dogs. Frente. Veterinario. Sci. 2018 , 5 , 165.
- Philpott, HT; O'Brien, M .; McDougall, JJ A atenuação da fase inicial da inflamação pelo canabidiol previne a dor e os danos aos nervos na osteoartrite de ratos. Pain 2017 , 158 , 2442–2451.
- Malfait, AM; Gallily, R .; Sumariwalla, PF; Malik, AS; Andreakos, E .; Mechoulam, R .; Feldmann, M. O cannabis constituinte não psicoativo da cannabis é um medicamento anti-artrítico oral na artrite induzida por colágeno murino. Proc. Natl. Acad. Sci. USA 2000 , 97 , 9561–9566.
- Lowin, T .; Tingting, R .; Zurmahr, J .; Classen, T .; Schneider, M .; Pongratz, G. Cannabidiol (CBD): Um assassino para fibroblastos sinoviais de artrite reumatóide inflamatória. Cell Death Dis. 2020 , 11 , 1-11.
- Winklmayr, M .; Gaisberger, M .; Kittl, M .; Fuchs, J .; Ritter, M .; Jakab, M. Dose-Dependent Cannabidiol-Induced Elevation of Intracellular Calcium and Apoptosis in Human Articular Chondrocytes. J. Orthop. Res. 2019 , 37 , 2540–2549.
- Genaro, K .; Fabris, D .; Arantes, ALF; Zuardi, AW; Crippa, JAS; Prado, WA O canabidiol é um potencial terapêutico para a dimensão afetivo-motivacional da dor de incisão em ratos. Frente. Pharmacol. 2017 , 8 , 391.
- Wong, H .; Cairns, BE Cannabidiol, cannabinol e suas combinações agem como analgésicos periféricos em um modelo de rato de dor miofascial. Arco. Oral Biol. 2019 , 104 , 33–39.
- Rodríguez-Muñoz, M .; Onetti, Y .; Cortés-Montero, E .; Garzón, J .; Sánchez-Blázquez, P. Cannabidiol aumenta a antinocicepção da morfina, diminui as convulsões mediadas por NMDA e reduz os danos do AVC através do receptor sigma 1 11 Ciências Médicas e da Saúde 1109 Neurociências 11 Ciências Médicas e da Saúde 1115 Farmacologia e Ciências Farmacêuticas. Mol. Brain 2018 , 11 , 1-12.
- Neelakantan, H .; Tallarida, RJ; Reichenbach, ZW; Tuma, RF; Ward, SJ; Walker, EA Interações distintas de canabidiol e morfina em três modelos comportamentais nociceptivos em camundongos. Behav. Pharmacol. 2015 , 26 , 304-314.
- Crivelaro do Nascimento, G .; Ferrari, DP; Guimarães, FS; Del Bel, EA; Bortolanza, M .; Ferreira, NC, Jr. O canabidiol aumenta o limiar nociceptivo em um modelo pré-clínico da doença de Parkinson. Neuropharmacology 2020 , 163 , 107808.
- Finn, DP; Beckett, SRG; Roe, CH; Madjd, A .; Fone, KCF; Kendall, DA; Marsden, CA; Chapman, V. Effects of coadministration of cannabinoids and morphine on nociceptive behavior, brain monoamines and HPA axis activity in a rat model of persistent pain. EUR. J. Neurosci. 2004 , 19 , 678–686.
- Cunha, JM; Carlini, EA; Pereira, AE; Ramos, OL; Pimentel, C .; Gagliardi, R .; Sanvito, WL; Lander, N .; Mechoulam, R. administração crônica de canabidiol a voluntários saudáveis e pacientes epilépticos. Pharmacology 1980 , 21 , 175–185.
- Consroe, P .; Laguna, J .; Allender, J .; Snider, S .; Stern, L .; Sandyk, R .; Kennedy, K .; Schram, K. Ensaio clínico controlado de canabidiol na doença de Huntington. Pharmacol. Biochem. Behav. 1991 , 40 , 701–708.
- Wade, DT; Makela, P .; Robson, P .; House, H .; Bateman, C. Os extratos medicinais à base de cannabis têm efeitos gerais ou específicos sobre os sintomas da esclerose múltipla? Um estudo duplo-cego, randomizado e controlado por placebo em 160 pacientes. Mult. Scler. 2004 , 10 , 434–441.
- Cuñetti, L .; Manzo, L .; Peyraube, R .; Arnaiz, J .; Curi, L .; Orihuela, S. Tratamento da Dor Crônica com Canabidiol em Pacientes com Transplante Renal no Uruguai. Transplante. Proc. 2018 , 50 , 461–464.
- Taylor, L .; Gidal, B .; Blakey, G .; Tayo, B .; Morrison, G. A Phase I, Randomized, Double-Blind, Placebo-Controlled, Single Ascending Dose, Multiple Dose, and Food Effect Trial of the Safety, Tolerability and Pharmacokinetics of Highly Purified Cannabidiol in Healthy Subject. CNS Drugs 2018 , 32 , 1053–1067.
- Devinsky, O .; Patel, AD; Thiele, EA; Wong, MH; Appleton, R .; Harden, CL; Greenwood, S .; Morrison, G .; Sommerville, K. Randomized, dose-variando a segurança do canabidiol na síndrome de Dravet. Neurology 2018 , 90 , e1204 – e1211.
- Manini, AF; Yiannoulos, G .; Bergamaschi, MM; Hernandez, S .; Olmedo, R .; Barnes, AJ; Winkel, G .; Sinha, R .; Jutras-Aswad, D .; Huestis, MA; et al. Segurança e farmacocinética do Canabidiol oral quando administrado concomitantemente com Fentanil intravenoso em humanos. J. Addict. Med. 2015 , 9 , 204.
- Xu, DH; Cullen, BD; Tang, M .; Fang, Y. The Effectiveness of Topical Cannabidiol Oil in Symptomatic Relief of Peripheral Neuropathy of the Lower Extremities. Curr. Pharm. Biotechnol. 2019 , 21 , 390–402.
- Szaflarski, JP; Bebin, EM; Cutter, G .; DeWolfe, J .; Dure, LS; Gaston, TE; Kankirawatana, P .; Liu, Y .; Singh, R .; Standaert, DG; et al. O canabidiol melhora a frequência e a gravidade das convulsões e reduz os eventos adversos em um estudo prospectivo complementar aberto. Epilepsy Behav. 2018 , 87 , 131–136.
- Devinsky, O .; Patel, AD; Cross, JH; Villanueva, V .; Wirrell, EC; Privitera, M .; Greenwood, SM; Roberts, C .; Checketts, D .; VanLandingham, KE; et al. Efeito do canabidiol nas crises convulsivas na síndrome de Lennox-gastaut. N. Engl. J. Med. 2018 , 378 , 1888–1897.
- Thiele, EA; Marsh, ED; Francês, JA; Mazurkiewicz, MB; Benbadis, SR; Joshi, C .; Lyons, PD; Taylor, A .; Roberts, C .; Sommerville, K .; et al. Canabidiol em pacientes com convulsões associadas à síndrome de Lennox-Gastaut (GWPCARE4): Um ensaio de fase 3 randomizado, duplo-cego e controlado por placebo. Lancet 2018 , 391 , 1085–1096.
- Laux, LC; Bebin, EM; Checketts, D .; Chez, M .; Flamini, R .; Marsh, ED; Miller, I .; Nichol, K .; Park, Y .; Segal, E .; et al. Segurança e eficácia a longo prazo do canabidiol em crianças e adultos com síndrome de Lennox-Gastaut ou síndrome de Dravet resistente ao tratamento: resultados do programa de acesso expandido. Epilepsy Res. 2019 , 154 , 13–20.
- Devinsky, O .; Cross, JH; Laux, L .; Marsh, E .; Miller, I .; Nabbout, R .; Scheffer, IE; Thiele, EA; Wright, S. Trial of cannabidiol for drug-resistente convulsions in the dravet syndrome. N. Engl. J. Med. 2017 , 376 , 2011–2020.
- Capano, A .; Weaver, R .; Burkman, E. Avaliação dos efeitos do extrato de cânhamo CBD no uso de opióides e indicadores de qualidade de vida em pacientes com dor crônica: Um estudo de coorte prospectivo. Pós-graduação. Med. 2020 , 132 , 56-61.
- Van De Donk, T .; Niesters, M .; Kowal, MA; Olofsen, E .; Dahan, A .; Van Velzen, M. Um estudo experimental randomizado sobre os efeitos analgésicos da cannabis de grau farmacêutico em pacientes com dor crônica com fibromialgia. Pain 2019 , 160 , 860–869.
- Hoggart, B .; Ratcliffe, S .; Ehler, E .; Simpson, KH; Hovorka, J .; Lejčko, J .; Taylor, L .; Lauder, H .; Serpell, M. Um estudo multicêntrico, aberto e de acompanhamento para avaliar a manutenção a longo prazo do efeito, tolerância e segurança do spray oromucoso de THC / CBD no tratamento da dor neuropática. J. Neurol. 2015 , 262 , 27–40.
- Serpell, M .; Ratcliffe, S .; Hovorka, J .; Schofield, M .; Taylor, L .; Lauder, H .; Ehler, E. Um estudo de grupo paralelo duplo-cego, randomizado, controlado por placebo, de spray de THC / CBD no tratamento da dor neuropática periférica. EUR. J. Pain 2014 , 18 , 999–1012.
- Johnson, JR; Burnell-Nugent, M .; Lossignol, D .; Ganae-Motan, ED; Potts, R .; Fallon, MT Multicêntrico, Duplo-Cego, Randomizado, Controlado por Placebo, Estudo de Grupo Paralelo da Eficácia, Segurança e Tolerabilidade de THC: Extrato de CBD e Extrato de THC em Pacientes com Dor Intratável Relacionada ao Câncer. J. Pain Symptom Manag. 2010 , 39 , 167-179.
- Johnson, JR; Lossignol, D .; Burnell-Nugent, M .; Fallon, MT Um estudo de extensão aberto para investigar a segurança e tolerabilidade em longo prazo do spray oromucoso de THC / CBD e do spray oromucoso de THC em pacientes com dor terminal relacionada ao câncer refratária a analgésicos opioides fortes. J. Pain Symptom Manag. 2013 , 46 , 207–218.
- Russo, M .; Naro, A .; Leo, A .; Sessa, E .; D'Aleo, G .; Bramanti, P .; Calabrò, RS Avaliando sativex ® no tratamento da dor neuropática: Uma avaliação clínica e neurofisiológica na esclerose múltipla. Pain Med. 2016 , 17 , 1145–1154.
- Portenoy, RK; Ganae-Motan, ED; Allende, S .; Yanagihara, R .; Shaiova, L .; Weinstein, S .; McQuade, R .; Wright, S .; Fallon, MT Nabiximols para pacientes com câncer tratados com opióides com dor crônica mal controlada: um ensaio randomizado, controlado com placebo, de dose graduada. J. Pain 2012 , 13 , 438–449.
- Nurmikko, TJ; Serpell, MG; Hoggart, B .; Toomey, PJ; Morlion, BJ; Haines, D. Sativex trata com sucesso a dor neuropática caracterizada por alodinia: Um ensaio clínico randomizado, duplo-cego, controlado por placebo. Pain 2007 , 133 , 210–220.
- Blake, DR; Robson, P .; Ho, M .; Jubb, RW; McCabe, CS Avaliação preliminar da eficácia, tolerabilidade e segurança de um medicamento à base de cannabis (Sativex) no tratamento da dor causada pela artrite reumatóide. Rheumatology 2006 , 45 , 50–52.
- Lichtman, AH; Lux, EA; McQuade, R .; Rossetti, S .; Sanchez, R .; Sun, W .; Wright, S .; Kornyeyeva, E .; Fallon, MT Resultados de um estudo duplo-cego, randomizado e controlado por placebo de nabiximóis oromucosal spray como terapia adjuvante em pacientes com câncer avançado com dor crônica não controlada. J. Pain Symptom Manag. 2018 , 55 , 179-188.
- Lynch, ME; Cesar-Rittenberg, P .; Hohmann, AG Um ensaio piloto cruzado, duplo-cego, controlado por placebo, com extensão usando um extrato canabinóide da mucosa oral para o tratamento da dor neuropática induzida por quimioterapia. J. Pain Symptom Manag. 2014 , 47 , 166-173.
- Santoro, M .; Mirabella, M .; De Fino, C .; Bianco, A .; Lucchini, M .; Losavio, F .; Sabino, A .; Nociti, V. efeitos do Sativex ® na metilação do promotor e na expressão de CNR1 / CNR2 em células mononucleares do sangue periférico de pacientes com esclerose múltipla progressiva. J. Neurol. Sci. 2017 , 379 , 298–303.
- Martin-Santos, RA; Crippa, J .; Batalla, A .; Bhattacharyya, S .; Atakan, Z .; Borgwardt, S .; Allen, P .; Seal, M .; Langohr, K .; Farre, M .; et al. Efeitos agudos da administração de uma dose oral única de d9-tetrahidrocanabinol (THC) e canabidiol (CBD) em voluntários saudáveis. Curr. Pharm. Des. 2012 , 18 , 4966–4979.
- Schoedel, KA; Szeto, I .; Setnik, B .; Vendedores, EM; Levy-Cooperman, N .; Mills, C .; Etges, T .; Sommerville, K. Avaliação do potencial de abuso de canabidiol (CBD) em usuários de múltiplas drogas recreativas: um ensaio clínico randomizado, duplo-cego e controlado. Epilepsy Behav. 2018 , 88 , 162–171.
- Ignatowska-Jankowska, B .; Jankowski, M .; Glac, W .; Swiergiel, AH A linfopenia induzida por canabidiol não envolve células NKT e NK. J. Physiol. Pharmacol. 2009 , 60 , 99–103.
- Calvey, TN; Williams, NE Princípios e Prática de Farmacologia para Anestesistas ; John Wiley & Sons, Inc .: Hoboken, NJ, EUA, 2008.
Nota do editor: o MDPI permanece neutro em relação às reivindicações jurisdicionais em mapas publicados e afiliações institucionais. |
© 2020 pelos autores. Licenciado MDPI, Basel, Suíça. Este é um artigo de acesso aberto distribuído sob os termos e condições da licença Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/ ).
Observação: tradução livre do Google
Imagens e tabelasnão foram traduzidos

Nenhum comentário:
Postar um comentário
O que achou da matéria? Ajudou-lhe de alguma forma? Deixe sua opinião e seu comentário: Agradecemos!